Chapitre 7
RECEPTEUR D’ANTIGENE ET
GENERATION DU REPERTOIRE DES LYMPHOCYTES B
I- Introduction
Les lymphocytes B représentent environ 5 à 15% des lymphocytes circulants et sont classiquement définis par la présence d’immunoglobulines de surface. Ces immunoglobulines sont produites par la cellule elle-même. Elles jouent le rôle de récepteur spécifique pour l’antigène (BcR : B cell receptor). La majorité des cellules B périphériques humaines expriment à leur surface des Ig de deux classes, IgM et IgD. Sur la même cellule, ces immunoglobulines d’isotypes différents possèdent les mêmes sites anticorps. Dans le sang, très peu de cellules expriment des IgG, des IgA ou des IgE de surface, mais on détecte un grand nombre de ces cellules dans certains sites spécifiques (cellules à IgA dans l’intestin par exemple). Le BcR est associé à des molécules responsables de la transduction du signal après contact avec l’antigène, les chaînes Iga et Igb. Parmi les autres marqueurs présents à la surface du lymphocyte B on note les antigènes de classe II du CMH qui interviennent dans la présentation des antigènes aux lymphocytes T, les récepteurs du C3b et du C3d du complément, et les marqueurs CD19, CD21, CD81 et CD45 qui jouent un rôle dans l’activation du lymphocyte B. La molécule CD5, exprimée par les cellules T, est aussi retrouvée sur une sous-population de lymphocytes B : les lymphocytes B-1a. Ces lymphocytes B1-a, pratiquement absents du sang périphérique, sont retrouvés majoritairement dans les cavités pleurale et péritonéale. Ils sont responsables de la production des auto-anticorps naturels.
II – Le récepteur de l’antigène des lymphocytes B
A-
Génération du répertoire B : diversité des Ig de membrane du lymphocyte B
La reconnaissance spécifique de l’antigène est la caractéristique de la réponse immunitaire adaptative.
Deux molécules sont impliquées dans ce processus
1. Le récepteur de l’antigène des lymphocytes T (TcR).
2. Les Immunoglobulines (Ig) des lymphocytes B.
Figure 1 : Structure du récepteur de
l’antigène des lymphocytes B.
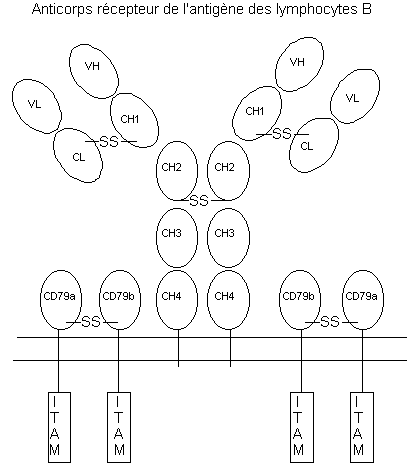
Ces deux familles de molécules sont caractérisées par leur diversité et leur variabilité, produits des recombinaisons des gènes codant les chaînes des récepteurs de l’antigène.
Le nombre élevé d’antigènes susceptibles d’être rencontrés par l’organisme implique que le système génétique doit permettre la synthèse d’au moins plusieurs millions de molécules différentes, dont une partie (partie constante) est absolument invariable à l’acide aminé près, et dont l’autre partie doit être variable et spécifique d’un ligand (motif antigénique : épitope). Celui-ci peut être totalement synthétique et n’avoir jamais existé dans la nature. Plusieurs immunoglobulines peuvent avoir des parties variables identiques et des parties constantes différentes : IgM et IgD de surface ou passage des IgM au IgG sans changement de spécificité (switch ou commutation isotypique). Le système doit être stable et posséder une mémoire permettant la réactivation de la synthèse d’immunoglobulines à spécificité identique plusieurs dizaines d’années plus tard. Une même cellule ne peut synthétiser qu’un seul type d’anticorps malgré la présence de deux chromosomes (exclusion allélique)
La diversité des anticorps résulte en premier lieu de recombinaisons génétiques au niveau somatique entre des gènes codant les parties variables et le gène codant la partie constante.
B – Diversité combinatoire
B-1-Organisation
des gènes codant les chaînes légères d’immunoglobulines
B-1-1
Chaînes Kappa
Figure
2 : Organisation
des gènes codant les chaînes légères Kappa
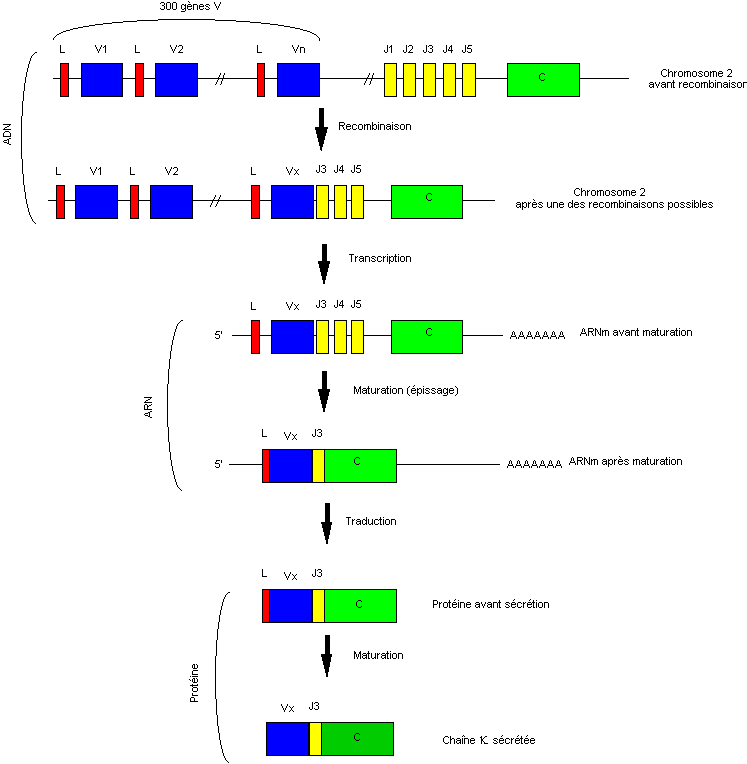
L'ensemble des gènes présidant à la synthèse des chaînes
kappa est, chez l'homme, situé sur le chromosome 2. La synthèse d'une chaîne
kappa nécessite l'intervention de trois gènes, un gène V ou gène variable, un
gène J ou gène de jonction et le gène C ou gène de la partie constante. Ces
domaines sont organisés dans cet ordre aussi bien sur le chromosome que dans la
chaîne polypeptidique.
L'homme possède environ 300 gènes Vk. Chacun est précédé par une courte séquence, la séquence leader (L), séparée du gène V proprement dit par un court intron. Cette séquence leader code le peptide signal qui indique à la cellule que la chaîne polypeptidique doit être sécrétée. L'intron est excisé lors de la maturation du mRNA.
Les gènes J sont au nombre de 5, et sont constitués chacun d'environ 39 paires de bases. Le groupe des 5 gènes J s'étend sur 500 à 700 paires de bases. Ce groupe de gènes J est situé quelques centaines de kb en aval du groupe des gènes V, et 2 à 3 kb en amont du gène C. Enfin le groupe de gènes des chaînes kappa se termine par l'unique gène C qui ne contient pas d'intron.
Le gène recombiné est transcrit en mRNA dont la maturation va conduire à l'excision de l'intron entre la séquence leader et le gène V et de l'intron qui sépare le gène J choisi et le gène C. Le messager est traduit en un polypeptide qui perd son peptide signal lors de la sécrétion.
La formation
d'un gène kappa fonctionnel résulte d'une recombinaison entre un gène V et un
gène J
En utilisant la technique de Southern, l'équipe de
Tonegawa montra que le gène V est plus éloigné du gène C dans les cellules
germinales qu'il ne l'est dans les cellules sécrétantes (il s'agissait en
l'occurrence de cellules d'un myélome de souris). Au cours de la maturation du
lymphocyte pré-B une recombinaison met bout à bout l'extrémité 3' d'un gène
variable pris au hasard et l’extrémité 5' de l'un des 5 gènes J lui aussi pris
au hasard. Le DNA qui séparait ces deux points avant la recombinaison est
éliminé.
Par ce mécanisme le gène variable est rapproché du gène C
; le complexe V-J n'en est plus séparé que par un intron de 2 à 3 kb. Cet
intron sera éliminé par épissage lors de la maturation du mRNA.
La
recombinaison met en jeu des séquences spécifiques : le complexe
Heptamère-Nonamère
La recombinaison V/J s’explique par l’existence de
séquences complémentaires. Ces séquences sont constituées d’un heptamère et
d’un nonamère séparés par 23 paires de bases immédiatement en 3’ du gène V et
par 12 paires de bases immédiatement en 5’ du gène J. Les deux heptamères et
les deux nonamères s’associent ce qui a pour effet de mettre exactement bout à
bout les gènes V et J. Une recombinase qui reconnaît ce motif assure la
ligation des gènes V et J.
Figure 3: le complexe Heptamère-Nonamère
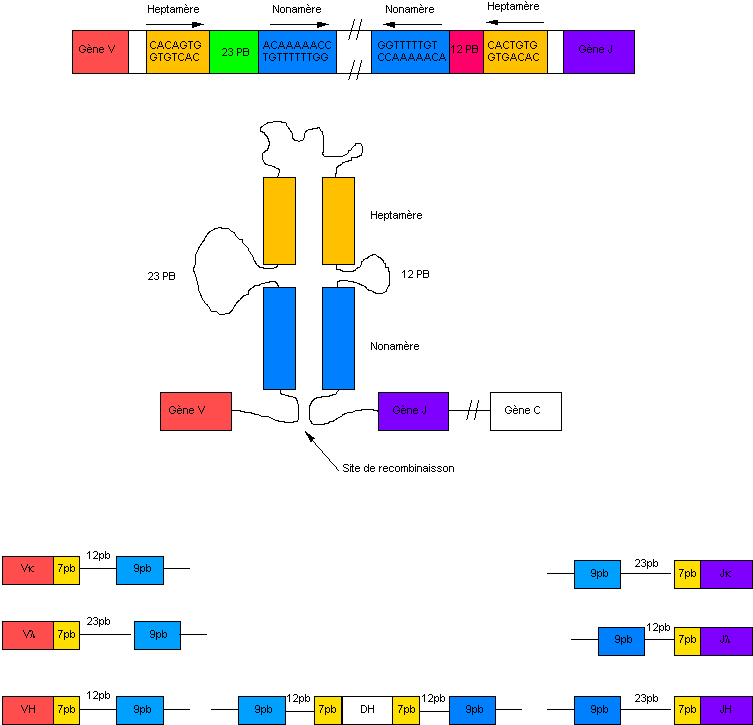
La recombinaison fait appel aux produits de deux gènes, RAG-1 et RAG-2 qui agissent en synergie
La recherche de la recombinase effectuant les différentes
recombinaisons a permis de cloner l’ADN complémentaire d'un gène qui fut appelé
RAG-1 (pour recombination activating gene). Ce gène n'est exprimé
que dans les cellules de la lignée lymphoïde, il est très conservé dans toutes
les espèces. Des expériences de transfection dans des fibroblastes ont montré
que la protéine codée par cet ADNc n'activait les recombinaisons VDJ qu'avec
une efficacité particulièrement faible, ce qui laissait supposer qu'un autre
facteur était nécessaire. La co-transfection de RAG-1 et d'un autre gène qui
lui est proche sur l’ADN (situé à 8 kb), le gène RAG-2, permet
d'obtenir une activité de recombinaison normale. Le produit du gène RAG-2
exacerbe d'un facteur 1000 l'activité de RAG-1. Le gène RAG-2 est lui aussi
très conservé dans les différentes espèces, mais il ne présente aucune
homologie de structure avec RAG-1. Ces gènes semblent dépourvus d'intron, les
masses moléculaires des protéines codées par RAG-1 et RAG-2 sont respectivement
de 55 et 58 kDa.
B-1-2
Chaînes lambda.
Le modèle des chaînes lambda est proche de celui des chaînes kappa
L'ensemble des gènes codant les chaînes lambda sont, chez l'homme, situés sur le chromosome 22.
Les mécanismes qui président à la synthèse et à la diversité des chaînes lambda sont identiques à ceux décrits pour les chaînes kappa. Seuls l'organisation et le nombre des gènes sont différents. La différence porte sur l'organisation des gènes J et le nombre des gènes constants.
Il
existe au moins 6 gènes C différents, chacun étant précédé d’un seul gène J qui
lui est propre. La recombinaison se fait au hasard entre l'un des gènes V et le
gène J de l'un des 6 complexes J/C.
Figure
4 : Organisation
des gènes codant les chaînes légères Lambda
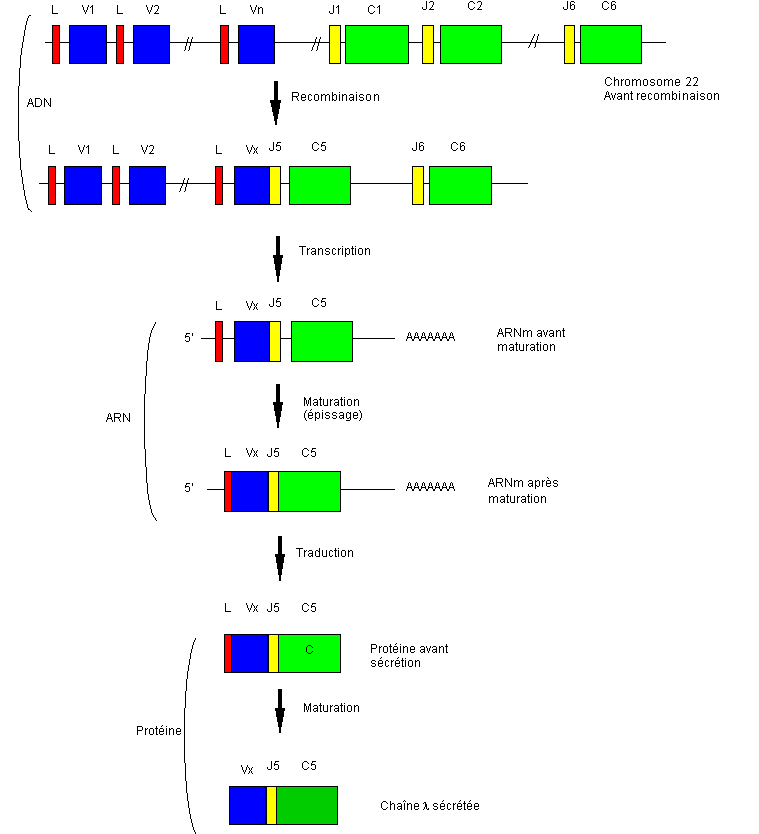
B-2-Organisation
des gènes codant les chaînes lourdes d’immunoglobulines
Figure
5 : Organisation
des gènes codant les chaînes lourdes d’immunoglobulines
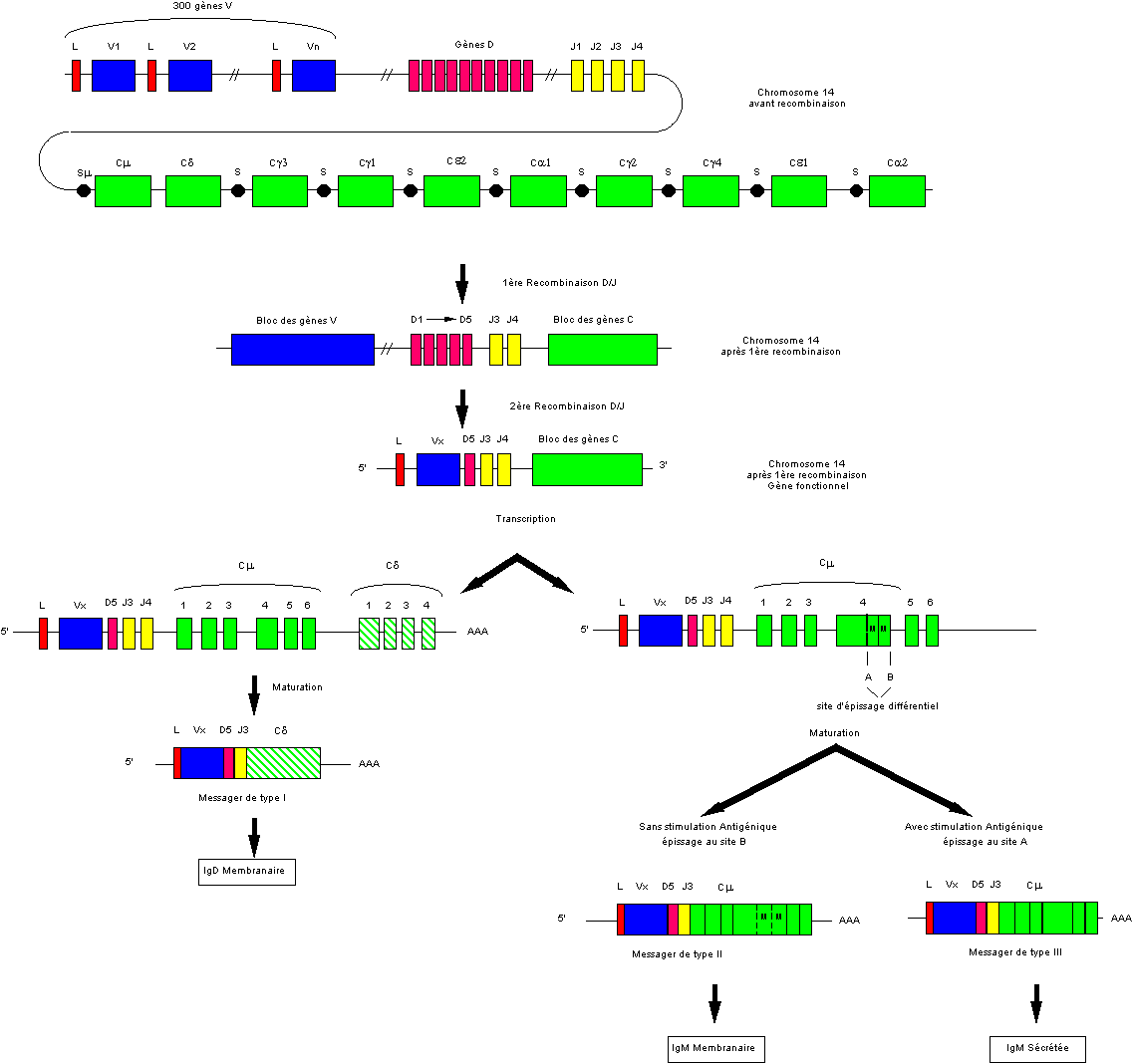
L'organisation des gènes codant les chaînes lourdes des
immunoglobulines ressemble à celle des chaînes kappa ; elle est cependant plus complexe
puisque l'on y retrouve un groupe de gènes supplémentaires, les gènes D ou
gènes de diversité. Ce groupe de gènes est localisé entre les gènes V et les
gènes J. Les gènes D sont au nombre d’une dizaine ; cependant, comme ces gènes
sont très courts - une douzaine de paires de bases - il est difficile de
déterminer avec précision leur nombre exact.
Une autre différence importante se situe au niveau des gènes constants codant chacun des isotypes. Ces gènes sont regroupés sur environ 200kb. On trouve dans l'ordre les gènes Cm, Cd, Cg3, Cg1, Ce2, Ca1, Cg2, Cg4, Ce1, Ca2.
Le gène Ca2 est un pseudogène ; il semble qu'il y ait aussi un pseudogène Cg. Contrairement aux gènes C des chaînes légères, ils ont des introns.
L’expression des chaînes lourdes nécessite
deux recombinaisons
La première se produit entre l'un des gènes D pris au hasard et l'un des gènes J aussi pris au hasard. Une seconde recombinaison met bout à bout un gène V pris au hasard et le complexe D-J résultant de la première recombinaison. Les mécanismes impliqués dans ces recombinaisons sont les mêmes que ceux utilisés pour les chaînes kappa et lambda.
C
– Diversité jonctionnelle
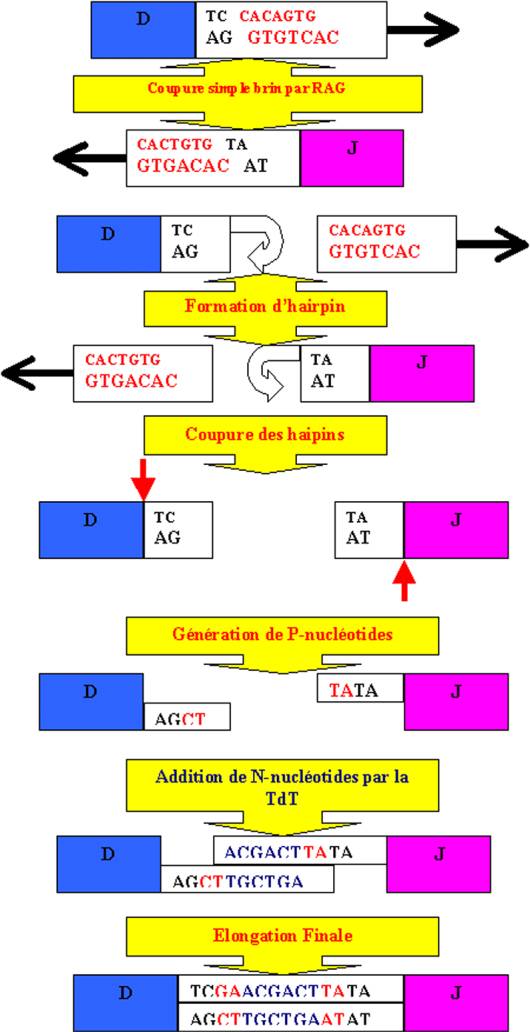
Comme si la diversité créée par simple recombinaison n’était pas suffisante, la position précise à laquelle les segments génétiques V(D)J se joignent peuvent légèrement varier.
La reconnaissance des séquences heptamères-nonamères
(RSS : recombination signal sequences) par les protéines RAG-1 et
RAG-2 conduit à la coupure à bout franc de l’ADN double brin situé entre les
RSS et le brin codant adjacent. Cette coupure libère une séquence signal qui
est éliminée. Les brins codants à bout franc vont, par action des protéines
RAG, former des " épingles à cheveux " par ligation des
nucléotides terminaux de chaque brin. La ligation des brins codants nécessitera
donc la coupure de ces hairpins. Des nucléases simple brin coupent l’ADN à
proximité des hairpins. Une coupure entre les deux brins d’ADN produit un bout
franc alors qu’une coupure à distance de la région terminale du brin codant
produit une petite extension simple brin. La ligation ne pouvant être réalisée
qu’entre deux brins codants d’ADN double brin, la partie d’ADN simple brin doit
être complétée ou éliminée afin d’obtenir un segment d’ADN double brin. Ce mécanisme
est à l’origine de la P diversité. Au niveau de la liaison D-J des chaînes
lourde on peut observer une modification supplémentaire des brins codants.
Cette modification correspond à l’ajout de nucléotides, le plus souvent des G,
en 3’ du brin codant. L’ajout de ces nucléotides est effectué par une
enzyme : la terminal deoxynucleotidyl transférase (TdT) et est à l’origine
de la N diversité.
Protéines impliquées dans la diversité
jonctionnelle
Outre les protéines RAG impliquées dans la reconnaissance
des RSS, la coupure et l’élimination de la séquence signal, d’autres protéines
sont impliquées dans les réarrangements.
Les protéines Ku 70-80 se fixent aux hairpins et les
protègent des nucléases cellulaires. Le complexe DNA-PKc est une enzyme à
activité sérine-thréonine kinase qui se fixe sur les protéines Ku rendant alors
accessibles les hairpins aux nucléases. Les hairpins sont alors rapidement
coupés et joints. Les enzymes qui interviennent dans la ligation sont l’ADN
ligase IV et XRCC4.
Figure
6 : Diversité
jonctionnelle
D - Régulation de l'expression des
gènes des immunoglobulines
Les mécanismes régulant l'expression des gènes des
immunoglobulines sont moins bien connus que ceux qui sont à l'origine de leur diversité.
Comme pour tout gène eucaryote classique les niveaux possibles sont multiples
et incomplètement élucidés.
Les gènes
des lmmunoglobulines sont sensibles à la DNase 1 dans les lymphocytes
Dans les tissus non lymphoïdes, les gènes des immunoglobulines ne présentent pas de sensibilité particulière vis-à-vis de la DNase 1 et sont hyperméthylés. Dans les lymphocytes pré-B, avant toute recombinaison, les gènes codant la partie constante des chaînes m sont hypométhylés, sensibles à la DNase 1 sur les deux chromosomes bien qu'un seul soit ultérieurement utilisé. Il en est de même au moins pour les gènes des chaînes légères kappa.
Après la recombinaison V-J , des sites d'hypersensibilité vis-à-vis de la DNase 1 deviennent détectables dans les gènes des immunoglobulines des lymphocytes matures sécrétants. Ces sites sont localisés dans la partie 5' non transcrite, dans l'intron situé entre le ou les gènes J et le gène C des chaînes légères et au niveau de la séquence S (impliquée dans le switch) de la chaîne m. Ce dernier site hypersensible est retrouvé, de manière étrange, aussi bien dans les lymphocytes B que dans les T qui eux ne sécréteront jamais d'immunoglobulines. Après le switch, les gènes codant les parties constantes des autres isotypes, qui n'étaient pas sensibles vis-à-vis de la DNase 1, le deviennent.
Les modifications de structure chromatinienne, en dehors
de celles révélées par l'hypersensibilité vis-à-vis de la DNase 1, ne semblent
donc pas directement liées à une transcription immédiate du gène puisque la
plupart se produisent avant même la recombinaison. Il semble plutôt s'agir d'un
acte de différenciation en lymphocyte pré-B qui prépare le terrain à la mise en
place ultérieure de la régulation transcriptionnelle proprement dite.
Une séquence
du promoteur et une séquence stimulatrice (enhancer) située entre J et C
permettent la régulation de l'expression des gènes d’Ig.
La régulation transcriptionnelle implique à la fois des
séquences en cis et des facteurs en trans. Mais la présence de nombreux gènes,
dont un seul doit être exprimé, rend encore plus complexe la régulation. La
simple interaction entre une séquence en cis et un facteur trans ne peut pas
être suffisante, sinon tous les gènes des immunoglobulines seraient activées
simultanément. De même il n'est pas envisageable qu'il existe un facteur
régulateur spécifique de chaque gène variable. La recombinaison somatique joue
donc un rôle majeur aussi bien au niveau de la génération de la diversité qu'au
niveau de la régulation transcriptionnelle du gène ainsi sélectionné.
Chaque gène V a sa région promotrice. On en retrouve aussi
en 5’ de certains gènes D et en 5’ des régions constantes des chaînes lourdes.
On peut transcrire une région C même sans réarrangement : tous les gènes
peuvent fonctionner à priori. Ainsi, il existe une activité transcriptionnelle
des gènes V à très bas niveau avant tout réarrangement. Cette activité augmente
fortement avant le réarrangement. De même, les gènes C peuvent être transcrits
avant que la cellule ne réarrange ou ne commute ses gènes d’immunoglobulines.
L'analyse des séquences en amont des gènes variables a
montré que les gènes variables des chaînes légères sont précédés de l'octamère
ATTTGCAT alors que les gènes variables des chaînes lourdes sont, eux, précédés par
la séquence complémentaire inverse ATGCAAAT. Sur ces séquences se fixent
spécifiquement des facteurs protéiques dont un, le facteur oct-2, a été
caractérisé. Ce facteur, qui appartient à la famille POU, n'est retrouvé que
dans les lymphocytes B ; il apparaît très tôt au cours de la différenciation en
lymphocytes B (au moment de la jonction D-J). Le même octamère est susceptible
de fixer aussi le facteur oct-1 qui, lui, est ubiquitaire. Cependant,
contrairement au facteur oct-2, il n'est pas capable à lui seul d'activer la
transcription (il nécessite d'autres facteurs accessoires), ce qui explique
qu'il est sans effet dans le lymphocyte B. Ces facteurs sont indispensables à
la bonne expression aussi bien des chaînes légères que des chaînes lourdes ;
ils ne sont retrouvés que dans les cellules lymphoïdes.
Ce mécanisme régulateur spécifique de tissu, important
dans la modulation de l'expression des gènes sélectionnés, n'explique cependant
pas pourquoi le seul gène V impliqué dans la recombinaison est significativement
transcrit.
La réponse a été apportée par les expériences de délétion au sein de l'intron qui sépare les gènes J et C. De telles délétions se traduisent par un effondrement du taux de transcription montrant que cet intron contient vraisemblablement une séquence stimulatrice (enhancer). Les expériences ont montré que les sites hypersensibles vis-à-vis de la DNase 1 localisés dans cet intron, déjà évoqués au paragraphe précédent, sont localisés en 5' de cette séquence stimulatrice. La recombinaison a donc pour effet de rapprocher de cette séquence le gène sélectionné dans la partie variable qui peut alors exercer son effet sur la transcription du seul gène V recombiné. Cette séquence stimulatrice est spécifique de tissu car elle demeure sans effet lorsqu'elle est transfectée, après couplage à un gène reporter, dans une cellule autre qu'une cellule lymphoïde. Cette spécificité tissulaire résulte de l'interaction avec des protéines qui n'existent que dans les cellules lymphoïdes. L'analyse de cette séquence stimulatrice (enhancer) n'a pas permis de mettre en évidence d'homologie avec d'autres séquences stimulatrices connues. La structure de cette séquence est maintenant connue. Elle n'est pas la même dans les gènes des chaînes légères et dans les gènes des chaînes lourdes. La séquence stimulatrice des chaînes légères kappa est constituée dans l'ordre 5' vers 3' d'une séquence extinctrice silencer, d'une séquence KB et de trois séquences KE (KE1, KE2 et KE3). La séquence extinctrice semble empêcher l'expression ectopique du gène dans les cellules autres que les lymphocytes B. Son effet inhibiteur est levé dans les lymphocytes B qui possèdent un gène de chaîne légère kappa correctement réarrangé par un mécanisme non connu. La séquence KB est une séquence cis-activatrice qui fixe le facteur transcriptionnel NF-KB ; on ne sait encore rien du rôle ni du mécanisme d'action des séquences KE. La séquence stimulatrice des chaînes lourdes est constituée de 5' vers 3' des séquences mE1, mE5, mE2, p, mE3, mB, mE4 et de l'octamère retrouvé dans le promoteur. La spécificité tissulaire résulte surtout de l'interaction de facteurs avec les motifs p et mB. Les séquences E fixent des facteurs possédant des structures hélice-boucle-hélice. Lors des réarrangements, la région promotrice et l’enhancer sont rapprochés ce qui a pour effet d’augmenter la transcription des gènes V et C. Il faut maintenir la région activatrice lors du switch ce qui explique que l’enhancer soit situé en 5’ de la séquence de recombinaison Sm.
